

DOI: 10.26820/reciamuc/4.(3).julio.2020.193-207
URL: https://reciamuc.com/index.php/RECIAMUC/article/view/513
EDITORIAL: Saberes del Conocimiento
Revista: RECIAMUC
ISSN: 2588-0748
Tipo de Investigación: Artículo de Revisión
Código UNESCO: 32 Ciencias Médicas
Paginas: 193-207

Andrea Ortiz-Ordoñez1; José Leonardo Grisman Laverde2; Natalia Acevedo Rojas3; Ibeth Alexandra Santafé Parra4
 https://orcid.org/0000-0002-1483-7974
https://orcid.org/0000-0002-1483-7974 https://orcid.org/0000-0003-3396-4757
https://orcid.org/0000-0003-3396-4757 https://orcid.org/0000-0002-5021-5590
https://orcid.org/0000-0002-5021-5590 https://orcid.org/0000-0002-5022-098X
https://orcid.org/0000-0002-5022-098XCORRESPONDENCIA
Andrea Carolina Ortiz Ordoñez
aortizo@estud.usfq.edu.ec
Quito, Ecuador
La hemorragia intracerebral es un importante problema de salud pública que genera altas tasas de muerte y discapacidad en adultos. El número de ingresos hospitalarios relacionados con esta patología ha aumentado en todo el mundo en los últimos 10 años; sin embargo, la mortalidad no ha disminuido. Los resultados de los ensayos clínicos y los estudios observacionales sugieren que la atención primaria y especializada coordinada se asocia con una mortalidad más baja que la práctica comunitaria típica. El desarrollo de objetivos de tratamiento para cuidados intensivos y nuevas secuencias de atención especializada, pueden mejorar el resultado después de una hemorragia intracerebral. Los enfoques de tratamiento específicos incluyen el diagnóstico temprano y la hemostasia, el manejo agresivo de la presión arterial, la cirugía abierta, las técnicas quirúrgicas mínimamente invasivas para eliminar el coágulo, las técnicas para eliminar la sangre intraventricular y el manejo de la presión intracraneal.
Palabras claves: Hemorragia intracerebral, mortalidad, salud pública, tratamiento.
Intracerebral hemorrhage is a major public health problem that generates high rates of death and disability in adults. The number of hospital admissions related to this pathology has increased worldwide in the last 10 years; however, mortality has not decreased. Results from clinical trials and observational studies suggest that coordinated primary and specialty care is associated with lower mortality than typical community practice. The development of treatment goals for intensive care and new sequences of specialized care can improve the outcome after an intracerebral hemorrhage. Specific treatment approaches include early diagnosis and hemostasis, aggressive blood pressure management, open surgery, minimally invasive surgical techniques to remove the clot, techniques to remove intraventricular blood, and management of intracranial pressure.
Keywords: Intracerebral hemorrhage, mortality, public health, treatment.
A hemorragia intracerebral é um importante problema de saúde pública que gera altas taxas de mortalidade e incapacidade em adultos. O número de internações hospitalares relacionadas a essa patologia aumentou em todo o mundo nos últimos 10 anos; no entanto, a mortalidade não diminuiu. Os resultados de ensaios clínicos e estudos observacionais sugerem que os cuidados primários e especializados coordenados estão associados a uma mortalidade mais baixa do que a prática comunitária típica. O desenvolvimento de metas de tratamento para cuidados intensivos e novas sequências de cuidados especializados podem melhorar o resultado após uma hemorragia intracerebral. Abordagens de tratamento específicas incluem diagnóstico precoce e hemostasia, controle agressivo da pressão arterial, cirurgia aberta, técnicas cirúrgicas minimamente invasivas para remover o coágulo, técnicas para remover sangue intraventricular e controle da pressão intracraniana.
Palavras-chave: Hemorragia intracerebral, mortalidade, saúde pública, tratamento.
INTRODUCCIÓN
La hemorragia intracerebral no traumática es el resultado de la rotura de los vasos sanguíneos del cerebro. Es un importante problema de salud pública con una incidencia anual de 10-30 por 100 000 habitantes, lo que representa 2 millones (10-15%) de aproximadamente 15 millones de accidentes cerebrovasculares en todo el mundo cada año (Organización Mundial de la Salud, 2017). Sus causas son variadas desde hipertensivas, aneurismáticas, malformaciones arteriovenosas, tumorales. En esta revisión nos enfocaremos las catalogadas como primarias. Las causas tumorales o vasculares han sido excluidas de este trabajo.
Metodología
Se realizo revisión de la literatura en español e inglés usando buscadores como PubMED, Google scholar y Scielo sobre hemorragia intracerebral espontanea primeria. Se usó palabras clave como epidemiologia, fisiopatología, mortalidad y manejo. Se incluyeron solo causas primarias y se excluyó toda información referente a causas secundarias.
Este artículo de revisión resume el estado actual de comprensión la hemorragia subaracnoidea espontanea. Busca examinar y resumir los estudios publicados anteriormente, así como los importantes avances y descubrimientos recientes con el fin de reconocer las lagunas significativas en la investigación y generar debate e ideas para futuras investigaciones.
Davila et al (2015) indica que el desarrollo de la acción investigativa busca simplemente coordinar acciones enmarcadas en una revisión bibliográfica con el fin de complementar ideas previas sobre un tema específico.
Tipo de Investigación
Se presenta un estudio descriptivo documental y de revisión de la literatura; se basa en la recolección de la información a través de buscadores académicos para su presentación y análisis posterior.
Castro (2016) define la investigación documental como la que “se ocupa del estudio de problemas planteados a nivel teórico; la información requerida para abordarlos se encuentra básicamente en materiales impresos, audiovisuales y/o electrónicos”. (p.41).
Fuentes Documentales
Se recolectó 122 artículos publicados en revistas electrónicas relacionados con el tema mediante el uso de palabras claves. Se excluyeron 91 artículos que incluían información sobre causas secundarias de hemorragia intracerebral o estudios que incluían niños.
Castro, et al (2016) menciona que las fuentes documentales incorporadas en la investigación documental o bibliográfica, “representa la suma de materiales sistemáticos que son revisados en forma rigurosa y profunda para llegar a un análisis del fenómeno” (p.41).
Técnicas para la Recolección de la Información
Mediante el uso de buscadores académicos (PubMED, Google Scholar, Scielo) en idioma inglés y español incluyendo RTCs, revisiones de la literatura y guías clínicas. Se uso de palabras claves según MESH y tesauros y se excluyeron las que incluían información no relacionada.
Tal como lo expresa, Bolívar, (2015) “Las técnicas documentales proporcionan las herramientas esenciales y determinantes para responder a los objetivos formulados y llegar a resultados efectivos” (p. 58). Es decir, para responder con eficiencia a las necesidades investigativas, se introdujeron como técnica de recolección el método inductivo, que hizo posible llevar a cabo una valoración de los hechos de forma particular para llegar a la explicación desde una visión general.
Revisión
Los ingresos hospitalarios por hemorragia intracerebral han aumentado en un 18% en los últimos 10 años, probablemente debi- do al aumento en el número de adultos mayores, muchos de los cuales carecen de un control adecuado de la presión arterial y al uso creciente de anticoagulantes, trombolíticos y antiagregantes plaquetarios. Los mexicoamericanos, latinoamericanos, afroamericanos, nativos americanos, japoneses y chinos tienen una mayor incidencia en comparación con blancos estadounidenses. Estas diferencias se observan principalmente en la incidencia de hemorragia intracerebral profunda siendo más prominentes en personas jóvenes y de mediana edad. Está reportado que la incidencia podría haber disminuido en algunas poblaciones con un mejor acceso a la atención médica y el control temprano de la presión arterial. (Labovitz, Halim, & Boden-Albala, 2015).
Qureshi, Tuhrim, Broderick, & Batjer, (2011) en su estudio expresan “la hemorragia intracerebral primaria y secundaria (inducida por anticoagulantes) tiene cambios patológicos subyacentes simila- res”. Esta patología comúnmente afecta los lóbulos cerebrales, los ganglios basales, el tálamo, el tronco encefálico (predominante- mente la protuberancia) y el cerebelo como resultado de la rotura de vasos afectados por cambios degenerativos relacionados con la hipertensión o angiopatía amiloide cerebral.
La mayoría de las hemorragias en la he- morragia intracerebral relacionada con la hipertensión, se produce en o cerca de la bifurcación de pequeñas arterias perforantes que se originan en las arterias basilar o en las arterias cerebrales anterior, media o posterior, de esta manera Qureshi, Tuhrim, Broderick, & Batjer, (2011) exponen que “las pequeñas ramas de las arterias de 50 a 700 μm de diámetro suelen tener múltiples sitios de rotura; algunos están asociados con capas de agregados de plaquetas y fibrina”. Estas lesiones se caracterizan por la rotura de la lámina elástica, atrofia y fragmentación del músculo liso, disecciones y de- generación celular granular o vesicular. La aterosclerosis grave, incluida la deposición de lípidos, puede afectar en particular a los pacientes ancianos. La necrosis fibrinoide del subendotelio con dilataciones focales posteriores (micro aneurismas) conduce a la rotura en una pequeña proporción de pacientes.
La angiopatía amiloide cerebral se caracteriza por el depósito de péptido β-amiloi- de y cambios degenerativos (formación de micro aneurismas, escisión concéntrica, infiltrados inflamatorios crónicos y necrosis fibrinoide) en los capilares, arteriolas y arterias pequeñas y medianas de la corteza cerebral, leptomeninges, y cerebelo. La angiopatía amiloide cerebral conduce a una hemorragia intracerebral esporádica en ancianos, comúnmente asociada con variaciones en el gen que codifica la apoli- poproteína E, y un síndrome familiar en pa- cientes jóvenes, típicamente asociado con mutaciones en el gen que codifica la pro- teína precursora amiloide. Las anomalías de la materia (p. ej., leucoariosis) parecen aumentar el riesgo de hemorragia intracere- bral tanto esporádica como familiar, lo que sugiere una patogenia vascular compartida (Smith & Gurol, 2014).
La hemorragia intracerebral asociada con la toma de anticoagulantes orales afecta típicamente a pacientes con vasculopatías relacionadas con hipertensión crónica o angiopatía amiloide cerebral, lo que podría representar una exacerbación de un riesgo existente de enfermedad clínica y subclínica.
Fisiopatología
Las regiones que rodean a los hematomas se caracterizan por edema, apoptosis, ne- crosis y células inflamatorias. Los hemato- mas inducen lesión por disrupción mecá- nica de las neuronas y la glía, seguida de deformación mecánica que causa oligemia, liberación de neurotransmisores, disfun- ción mitocondrial, y despolarización de la membrana (Graham, McIntosh, & Maxwell, 2010).
Dependiendo de la gravedad de la disfunción mitocondrial, los resultados de la lesión van desde la supresión metabólica temporal (fase de hibernación) hasta la inflamación y necrosis celular. Una cascada secundaria de lesiones se inicia por los productos de la coagulación y la degradación de la hemoglobina, en particular la trombina, que activa la microglía 4 horas después de la lesión. La microglía activada libera productos que inducen la degradación de la barrera hematoencefálica, edema vasogénico y apoptosis en neuronas y glía. (Yang, Nakamura, & Hua, 2016)
La hemostasia se inicia mediante la activación local de las vías hemostáticas y el taponamiento mecánico. Sin embargo, alrededor del 73% de los pacientes evaluados dentro de las 3 h del inicio de los síntomas tienen algún grado de agrandamiento del hematoma hasta el 35% tienen agranda- miento clínicamente prominente (Figura Nº1). La mayor parte del agrandamiento del hematoma ocurre dentro de las 3 h, aunque el agrandamiento puede ocurrir hasta 12 h después del inicio y dura hasta 14 días. El gran volumen del edema temprano en relación con el volumen del hematoma es el que más contribuye al resultado. (Yang, Nakamura, & Hua, 2016)
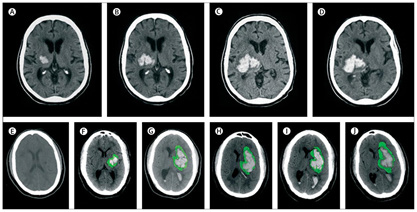
Figura 1. Evolución del hematoma y el edema en la TC
Nota: Arriba: expansión hiperaguda del hematoma en un paciente con hemorragia intra- cerebral en tomografías computarizadas seriadas. Pequeño hematoma detectado en ganglios basales y tálamo (A). Expansión del hematoma a los 151 min (B). Progresión continua del hematoma después de otros 82 min (C). Estabilización del hematoma después de otros 76 min (D). Abajo: progresión del hematoma y edema perihematomal en un paciente con hemorragia intracerebral en tomografías computarizadas seriadas. La primera exploración. (E) se adquirió antes de la hemorragia intracerebral. El edema de perihematoma se resalta en verde para facilitar el reconocimiento de la progresión del edema. A las 4 h del inicio de los síntomas hay un pequeño hematoma en los ganglios basales (F). Expansión del hematoma con extensión al ventrículo lateral y nuevo efecto de masa y desplazamiento de la línea media a las 14 h (G). Empeoramiento de la hidrocefalia y edema perihematomal precoz a las 28 h (H). Efecto de masa continuo con edema perihematomal prominente a las 73 h (I). Hematoma en resolución con edema perihematomal más prominente a los 7 días (J).
Fuente: Davis, Broderick, & Hennerici, 2006
El edema que es pequeño inicialmente puede aumentar de volumen en las primeras 24 h después de la hemorragia. Un hipo metabólico agudo e hipoperfusión (hibernación) fase, con disfunción mitocondrial e insuficiencia metabólica, se ha informado en la región circundante al hematoma (figura 2). La hipoperfusión regional en estudios clínicos y experimentales no siempre parece lo suficientemente grave como para inducir isquemia y podría ser secundaria a hipo metabolismo. En presencia de una presión intracraneal muy alta y una presión de perfusión cerebral baja, el riesgo de isquemia global es alto. Una fase de re- perfusión variable dura de 2 a 14 días, y se desarrolla una fase de normalización después de 14 días, con restablecimiento del flujo sanguíneo cerebral normal en todas las regiones viables. (Carhuapoma, Wang, & Beauchamp, 2010).
En presencia de una presión intracraneal muy alta y una presión de perfusión cerebral baja, el riesgo de isquemia global es alto. Una fase de reperfusión variable dura de 2 a 14 días, y se desarrolla una fase de normalización después de 14 días, con restablecimiento del flujo sanguíneo cerebral normal en todas las regiones viables. En presencia de una presión intracraneal muy alta y una presión de perfusión cerebral baja, el riesgo de isquemia global es alto. Una fase de reperfusión variable dura de 2 a 14 días, y se desarrolla una fase de normalización después de 14 días, con restablecimiento del flujo sanguíneo cerebral normal en todas las regiones viables.
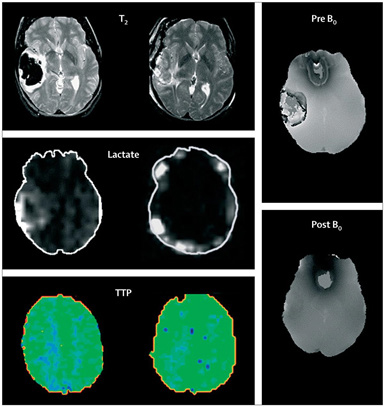
Figura 2. Resonancia magnética avanzada de hemorragia intracerebral lobar.
Nota: Izquierda: antes de la craneotomía. Medio: después de la craneotomía para el tratamiento del efecto de masa y la extirpación del hematoma. Los estudios secuenciales de T2, espectroscopia de resonancia magnética de lactato y perfusión mostraron disminuciones cualitativas del edema perihematomal y del lactato perihematomal y aumento de la perfusión regional occipital medida como el tiempo hasta el pico del inyectado en bolo (TTP) después de la eliminación del coágulo; La TTP está representada por la intensidad y distribución del color verde. Derecha: las imágenes de susceptibilidad magnética muestran una influencia paramagnética antes de la cirugía y una susceptibilidad limitada después de la extracción del coágulo de sangre que contiene hierro mediante craneotomía.
Fuente: Carhuapoma, Wang, & Beauchamp, 2010.
Diagnóstico y características clínicas
Aunque la tomografía computarizada es el enfoque diagnóstico de primera línea, la re- sonancia magnética con eco de gradiente puede detectar hemorragia intracerebral hi- peraguda con la misma sensibilidad y precisión general y es más precisa para la de- tección de microhemorragias (figura 3). La extravasación perihematomal de contraste intravenoso en la tomografía computarizada puede detectar hemorragia en curso. La angiografía cerebral es necesaria para diagnosticar causas secundarias de hemorragia intracerebral, como aneurismas, malformaciones arteriovenosas, trombosis venosas dúrales y vasculitis. La RM y la angiografía por resonancia magnética también pueden identificar causas secundarias de hemo- rragia intracerebral, como malformaciones cavernosas, aunque su sensibilidad no está bien establecida. (Kidwell, Chalela, & Saver, 2014).
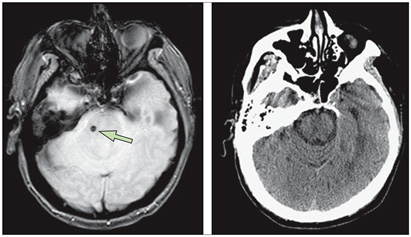
Figura 3. Detección de microhemorragias con resonancia magnética y tomografía computarizada
Nota: Izquierda: microhemorragia pontino asintomática (flecha) en un paciente con ictus isquémico que se muestra como hipo intensidad focal en la RM con eco de gradiente. Derecha: microangrado no detectado en la tomografía computarizada.
Fuente: Kidwell, Chalela, & Saver, 2014
Las presentaciones clásicas, como los déficits neurológicos focales de inicio rápido, la disminución de la conciencia y los signos de disfunción del tronco encefálico, están relacionados con el tamaño, la ubicación del hematoma y empeoramiento del edema. Los autores Labovitz, Halim, & Boden-Alba- la, (2015) cuando se refieren a la gravedad de la enfermedad predicen “muerte temprana, como la edad, la puntuación inicial en la escala de coma de Glasgow (GCS), el volumen del hematoma, el volumen sanguíneo ventricular y el agrandamiento del hematoma”.
En un estudio realizado por Weimar, Weber, & Wagner, (2013) se observó que la mor- talidad a los 3 meses fue del 34% en una revisión de 586 pacientes con hemorragia intracerebral de 30 centros. Sin embargo, en otros estudios fue del 31% a los 7 días, 59% al año, 82% a los 10 años y más del 90% a los 16 años. El riesgo posterior de otros eventos cardiovasculares fue del 4% para todos los accidentes cerebrovasculares, del 2% para la hemorragia intracerebral y del 1% para el accidente cerebrovascular isquémico por paciente-año Bailey, Hart, Benavente, & Pearce, (2011). Los pacientes con hemorragia lobar tenían una alta tasa de recurrencia (4% por paciente-año). La progresión asintomática de la enfermedad es particularmente común cuando se tienen en cuenta las microhemorragias y las anomalías de la sustancia blanca.
Evaluación y manejo
En una revisión de 1421 pacientes con hemorragia intracerebral, las limitaciones de la atención o el retiro de las intervenciones de soporte vital fue la causa más común (en 68%) de muerte Zurasky, Aiyagari, & Zazulia, (2015). Una encuesta a nivel estatal en los EE. UU mostró que las probabilidades de morir en el hospital eran mayores. aso- ciado con la frecuencia de uso de las órdenes de no resucitar Hemphill, Newman, Zhao, & Johnston, (2014). Estos estudios proporcionan evidencia indirecta de que el manejo médico agresivo y la atención especializada pueden mejorar el resultado general en pacientes con hemorragia intra- cerebral.En los EE. UU., la mortalidad se redujo sustancialmente para los pacientes ingresa- dos en hospitales universitarios urbanos, pero no en hospitales urbanos no docentes y hospitales rurales, lo que sugiere que las tendencias cambiantes en las admisiones podrían ser beneficiosas. Los ensayos que abordaron un solo factor de gravedad (volumen de hemorragia o agrandamiento del hematoma) han tenido éxito fisiológico, pero sin beneficio clínico. Estos resultados enfatizan que un solo enfoque de tratamiento podría lograr su objetivo fisiológico, pero ser insuficiente para producir un beneficio clínico, lo que abre la posibilidad de que la terapia multimodal bien organizada que aborde cada uno de los factores modificables, volumen del hematoma, sangre ventricular y agrandamiento del hematoma, pueda ser necesario (Tuhrim, 2008).
El soporte de las vías respiratorias, el con- trol de la presión arterial, el tratamiento de la presión intracraneal, y la reversión de la anticoagulación se inician comúnmente en los departamentos de emergencia, que también son el lugar de muchas primeras consultas neuroquirúrgicas para pacientes con hemorragia intracerebral. Los estudios observacionales muestran que alrededor del 30% de los casos los pacientes con hemorragia supratentorial y casi todos los pacientes con hemorragia del tronco encefálico o del cerebelo tienen disminución de la conciencia o disfunción del músculo bulbar que requiere intubación (Gujjar, Deibert, & Manno, 2008).
El deterioro rápido, la evidencia clínica de hernia transectorial o el efecto de masa o hidrocéfalo obstructivo en la neuroimagen, deben obligar a una emergencia o consulta neuroquirúrgica por posible colocación del catéter intraventricular o evacuación quirúrgica y uso concomitante de hiperventilación y manitol intravenoso. El riesgo de deterioro neurológico e inestabilidad cardiovascular es mayor en las primeras 24 h después del inicio de los síntomas, y es necesaria una evaluación frecuente del estado neurológico y las variables hemodinámicas de los pacientes en unidades de cuidados intensivos dedicadas.
Tratamiento hemostático agudo
Se ha propuesto algunas técnicas para prevenir el aumento de volumen del sangrado como por ejemplo el uso de factor VII recombinante activado (fVIIa) que podría promover la hemostasia en los sitios de lesión vascular y limita el agrandamiento del hematoma después de una hemorragia intracerebral. Sin embargo, hace falta más estudios al respecto para que esta medida se considere como alternativa terapéutica.
En un ensayo de fase II aleatorizado, doble ciego y controlado con placebo, se trató a 399 pacientes en las 3 h siguientes al inicio con placebo o 40 μm / kg, 80 μm / kg o 160 μg / kg de fVIIa. En general, el aumento medio en el volumen del hematoma fue del 29% en el grupo placebo, en comparación con el 11-16% en los grupos que recibieron fVIIa. La mortalidad a los 90 días fue del 29% para los pacientes que recibieron placebo y del 18% para los que recibieron fVIIa. (Mayer, Davis, & Beg- trup, 2008).
El ensayo de fase III, fVIIa para el tratamiento del accidente cerebrovascular hemorrágico agudo (FAST) evaluó la eficacia de fVIIa en pacientes con hemorragia intrace- rebral que se presentaron dentro de las 3 h del inicio de los síntomas. De 821 pacientes, 263 recibieron placebo, 265 recibieron 20 μg / kg y 293 recibieron 80 μg / kg de fVIIa. La capacidad de fVIIa para limitar la expansión fue similar a la del ensayo inicial para las dosis de 20 μg / kg y 80 μg / kg. Sin embargo, a los 3 meses, el 24% de los que recibieron placebo habían muerto o tenían discapacidad en comparación con el 26% y el 29% de los pacientes que recibieron 20 μg / kg y 80 μg / kg de fVIIa, respectivamente; la mortalidad no fue diferente entre los grupos. La tasa de trombosis arterial fue mayor en los pacientes tratados con 80 μg / kg de fVI- Ia (10%) que en los tratados con placebo (5%) o 20 μg / kg de fVIIa (6%). Por lo tanto, este ensayo fundamental de fVIIa no confirmó mejores resultados funcionales a pesar de producir una reducción significativa en la tasa de expansión del hematoma. La au- sencia de un beneficio importante para fVI- Ia, a pesar de su capacidad para estabilizar el sangrado sugiere, que los tratamientos adicionales como la evacuación quirúrgi- ca después de la estabilización, podría ser necesaria para cambiar la historia natural de la hemorragia intracerebral. El análisis de subgrupos del ensayo FAST sugirió un beneficio potencial para pacientes menores de 70 años, con un volumen de hematoma inicial menor de 60 ml, un volumen basal de hemorragia intraventricular menor de 5 ml y un tiempo desde el inicio menor o igual a 2 -5 h. (Mayer, Davis, & Begtrup, 2008).
Manejo clínico de la hipertensión intracraneal
De acuerdo con Dziedzic, Szczudlik, & Klimkowicz, (2013) “el efecto de masa resultante de los hematomas, el tejido edematoso que rodea a los hematomas y la hidrocefalia obstructiva con herniación posterior son una causa importante de muerte en los primeros días después de la hemorragia intracerebral”. La monitorización de la presión intracraneal podría identificar el riesgo de deterioro neurológico en pacientes con deterioro de la conciencia. Los cui- dados intensivos que conducen a una presión de perfusión cerebral controlada de 50-70 mm Hg podrían mejorar el resultado.
Dos ensayos aleatorizados no mostraron ningún beneficio sobre el flujo sanguíneo cerebral regional, mejoría neurológica, mortalidad y resultados funcionales del uso regular de bolos de manitol intravenoso. Por lo tanto, el uso a corto plazo de manitol en la hemorragia intracerebral solo se debe ser considerados en circunstancias especiales, tales como, hernia transectorial o deterioro neurológico agudo asociado con presión intracraneal alta o efecto de masa. Un estudio observacional de un solo centro sugirió que la reversión agresiva y oportuna de la hernia transectorial mediante el uso de hiperventilación y fármacos osmóticos mejoró el resultado a largo plazo (Qureshi, Geocadin, & Suarez, 2000).
El Stroke Council de la American Stroke Association (ASA) reconoce la ausencia de evidencia de ensayos clínicos definitivos en esta especialidad, pero recomienda la mo- nitorización de la presión intracraneal en pacientes tratados con diuréticos osmóticos, drenaje de líquido cefalorraquídeo mediante catéter ventricular, bloqueo neuromuscu- lar e hiperventilación. Las directrices de la European Stroke Initiative (EUSI) recomien- dan la monitorización de la presión intracraneal en pacientes que necesitan ventilación mecánica y recomiendan el tratamiento en pacientes que tienen deterioro neurológico relacionado con un aumento del edema cerebral en la neuroimagen o presión intracra- neal alta. Ambas guías recomiendan el uso selectivo de manitol, solución salina hiper- tónica e hiperventilación a corto plazo para mantener la presión por fusión cerebral su- perior a 70 mm Hg. (Broderick, Connolly, & Feldmann, 2007)
Manejo de la presión arterial sistémica
La respuesta hipertensiva aguda en la he- morragia intracerebral se caracteriza por su alta prevalencia, naturaleza autolimitante y significación pronóstica. La presión arterial alta puede ser secundaria a hipertensión crónica no controlada, con interrupción de las vías autónomas centrales por hemorra- gia intracerebral. La presión arterial alta se asocia con agrandamiento del hematoma y mal pronóstico; sin embargo, una causa exacta y la relación de efecto no está pro- bada.
Las guías de la ASA de 199955 se basan en la opinión de expertos y recomiendan reducir la presión arterial para mantener la presión arterial media por debajo de 130 mm Hg en pacientes con antecedentes de hipertensión. Los pacientes con hemorragia intracerebral tratados con infusión intrave- nosa de bloqueadores de los canales de calcio de acuerdo con las pautas de la ASA de 1999 dentro de las 24 h del inicio de los síntomas, toleraron bien el tratamiento, tu- vieron tasas bajas de deterioro neurológi- co, expansión del hematoma y control de la presión arterial que los regímenes de trata- miento antihipertensivo basados en infusión (Carhuapoma, Wang, & Beauchamp, 2010).
Las directrices actuales del ASA Stroke Council recomiendan "hasta que se com- pleten los ensayos clínicos en curso de in- tervención de la presión arterial para la he- morragia intracerebral, los médicos deben controlar la presión arterial sobre la base de la evidencia incompleta actual" mantenien- do la presión arterial sistólica por debajo de 180 mm Hg en la fase aguda período con fármacos antihipertensivos intravenosos de vida media corta. Ambas guías consideran una disminución más agresiva de la presión arterial sistólica en ausencia de signos clí- nicos de hipertensión intracraneal alta o hi- pertensión crónica. (Broderick, Connolly, & Feldmann, 2007)
Los datos recientes sugieren un mayor be- neficio terapéutico con una disminución más agresiva de la presión arterial. En un estudio observacional, no se observaron diferencias en las tasas de muerte y disca- pacidad a los 3 meses entre los pacientes tratados con una disminución agresiva y conservadora de la presión arterial en los estudios ATACH o INTERACT, aunque los análisis estuvieron limitados por tamaños de muestra pequeños. (Ohwaki & Yano, 2004)
Debido a que el efecto sobre el resultado clínico no se ha evaluado completamente, se deben seguir los objetivos más con- servadores establecidos en el ASA Stroke Council y las pautas de EUSI. Se recomien- da mucha precaución al reducir la presión arterial de manera demasiado agresiva sin un manejo concomitante de la presión de perfusión cerebral. Deben seguirse los ob- jetivos más conservadores establecidos en el ASA Stroke Council y las directrices EUSI.
Manejo de hemorragia intraventricular e hidrocefalia
Dos ensayos clínicos confirmaron que la hemorragia intraventricular y la hidrocefa- lia son predictores independientes de mal pronóstico en la hemorragia intracerebral espontánea Bhattathiri, Gregson, & Prasad, (2016). La alteración del flujo de líquido cefalorraquídeo y los efectos directos de masa de la sangre ventricular conducen a hidrocefalia obstructiva. El drenaje externo de líquido cefalorraquídeo a través de ca- téteres ventriculares reduce la presión in- tracraneal, pero los coágulos en el catéter y las infecciones, previenen efectos benefi- ciosos sostenidos sobre la hidrocefalia y el estado neurológico. En muchos pacientes el drenaje para la hidrocefalia comunicante podría reducir la tasa de infecciones.
La hemorragia intraventricular es un proce- so dinámico que sigue a la hemorragia in- tracerebral. En un estudio reciente de fVIIa, el 45% de 374 pacientes con hemorragia in- tracerebral tuvieron hemorragia intraventri- cular 24 h después de la presentación Stei- ner & Diringer, (2013). El crecimiento de las hemorragias intraventriculares ocurrió en el 17% de los pacientes tratados con place- bo y en el 10% de los que recibieron fVIIa. Los factores de riesgo para el crecimiento incluyeron una presión arterial media inicial de más de 120 mm Hg, un gran volumen inicial de hemorragia intracerebral, presen- cia de hemorragia intraventricular al inicio del estudio, tiempo más corto desde el ini- cio de los síntomas hasta la primera tomo- grafía computarizada y falta de tratamiento con fVIIa. La presencia de hemorragia intra- ventricular en cualquier momento y el cre- cimiento de ésta hemorragia aumentaron la probabilidad de muerte o discapacidad grave en 90 días.
Para facilitar el aclaramiento temprano y efectivo de la sangre en los ventrículos, los esfuerzos recientes se han centrado en el uso intraventricular de fármacos trombolíti- cos en pacientes que tienen hemorragia intraventricular en asociación con hemorragia intracerebral espontánea.
Evacuación quirúrgica
La evacuación quirúrgica puede prevenir la expansión, disminuir los efectos de masa, bloquear la liberación de productos neurotóxicos desde los hematomas y así prevenir el inicio de procesos patológicos. El ensayo Surgical Trial in Intracerebral Hemorrhage (STICH) comparó la cirugía temprana (tiempo medio de 20 h desde la presentación hasta la cirugía) con el tratamiento médico. En el estudio 1033 pacientes fueron asignados aleatoriamente a cirugía temprana o tratamiento conservador inicial. A los 6 meses, la cirugía temprana no tuvo ningún beneficio en comparación con el tratamiento conservador inicial: el 24% frente al 26% tuvo una buena recuperación o una discapacidad moderada después del tratamiento (Yang, Nakamura, & Hua, 2016).
El autor Mendelow & Unterberg, (2007) expresan que “los beneficios de la cirugía mediante craneotomía abierta pueden ser superados por el daño neural incurrido y la recurrencia del sangrado, especialmente en lesiones profundas”. En un análisis de subgrupos del ensayo STICH, El tratamiento quirúrgico de los hematomas lobares y los hematomas dentro de 1 cm de la superficie cortical fue más probable que beneficiosas. El ensayo STICH II ha comenzado y probará prospectivamente los beneficios de la cirugía en la hemorragia intracerebral lobar cuando los coágulos se extienden hasta 1 cm de la superficie cortical pero permanecen intraparenquimatosos sin extenderse al sistema ventricular. Otra indica- ción potencial para la cirugía es el empeoramiento neurológico agudo. (Mendelow & Unterberg, 2007)
Existe un debate del manejo cuando estos sangrados se encuentran en áreas elocuente o en su defecto en localicacion muy profunda como gangliobasal. Para limitar el daño neural y el riesgo de hemorragia recurrente asociado con la craneotomía abierta, los estudios ahora se están enfocando en la evacuación estereotáctica y endoscópica menos invasiva con eluso de fármacos trombolíticos.
Las guías de ASA Stroke Council y EUSI no recomiendan la evacuación rutinaria de la hemorragia supratentorial mediante craneotomía estándar dentro de las 96 h del ictus. Ambas guías recomiendan la cirugía para pacientes que presenten hemorragia lobular dentro de 1 cm de la superficie, particularmente para aquellos con buen esta- do neurológico que se están deteriorando clínicamente. Las guías reconocen que la extirpación operatoria dentro de las 12 h, particularmente con métodos mínimamente invasivos, tiene la mayor evidencia de efecto beneficioso y podría considerarse para hemorragias profundas en presencia de efecto de masa. Sin embargo, las guías señalan que la craneotomía muy temprana podría estar asociada con un mayor riesgo de hemorragia recurrente. (Broderick, Connolly, & Feldmann, 2007)
Consideración en la cirugía de la fosa posterior
La descompresión oportuna en los hematomas cerebelosos puede reducir la mor- bilidad y la mortalidad relacionadas con la compresión del tronco encefálico. En un análisis de los datos de un registro nacional de accidentes cerebrovasculares, pa- cientes tratados quirúrgicamente tuvieron una mejora significativamente mayor en los puntajes neurológicos que los tratados médicamente, independientemente de la edad y la gravedad inicial de los déficits Wang & Shuaib, (2007). En la mayoría de las instituciones, la evidencia de deterioro neurológico es una indicación para la eva- cuación quirúrgica; aunque la intervención quirúrgica antes del deterioro neurológico podría ser más beneficiosa si hay una com- presión severa del cuarto ventricular. Los mejores resultados funcionales se observan con la craneotomía temprana en pacientes con hemorragia cerebelosa. que tenían una puntuación inicial en la escala de coma de Glasgow de menos de 14 o hemorragias grandes (≥40 ml). La extirpación endoscópica de la hemorragia cerebelosa también puede extirpar eficazmente el hematoma con un tiempo de procedimiento menor y un período de drenaje de líquido cefalorra- quídeo más corto que con la craniectomía.
Las guías de ASA Stroke Council y EUSI recomiendan cirugía urgente para pacien- tes con hemorragias cerebelosas con un estado neurológico relativamente bueno o hematoma mayor de 3 cm que se están de- teriorando clínicamente, o que tienen com- presión del tronco encefálico o hidrocefalia por obstrucción ventricular. La hemorragia cerebelosa se complica comúnmente por hidrocefalia obstructiva con presión intra- craneal retardada pero en rápido aumento, que puede tratarse con éxito con drenaje ventricular externo. Las consecuencias de la hipertensión intracraneal prolongada con drenaje retardado deben evitarse mediante un control cuidadoso de la presión intracra- neal y el estado neurológico y uso de tomo- grafías computarizadas en serie. (Brode- rick, Connolly, & Feldmann, 2007)
Tratamiento neuro protector y convulsivo
La fisiopatología del daño cerebral primerio y secundario provocado por la presencia de sangre intraparenquimatosa hace difícil su manejo y se hace imprescindible más estudios al respecto. Se ha propuesto varias medidas y varios estudios se han puesto en marcha como el uso de NXY-059, un neuro protector que atrapa radicales libres, se investigó en un ensayo aleatorizado de 607 pacientes con hemorragia intracerebral dentro de las 6 h posteriores al inicio de los síntomas Sumer, Aci- kgoz, & Akpinar, (2012). Aunque el uso de NXY-059 se asoció con un crecimiento de hematoma ligeramente menor que el uso de placebo (cambio medio de 4 · 5 ml frente a 6 · 7 ml), en comparación de las exploraciones iniciales con las 72 h después del inicio del tratamiento, el fármaco no tuvo ningún efecto sobre la mortalidad a los 3 meses, la discapacidad o las puntuaciones de déficit neurológico.
Manejo de otras complicaciones clínicas asociadas
Aproximadamente el 30% de los pacientes con hemorragia intracerebral tienen hemo- rragias gástricas. Los bloqueadores H2 profilácticos o los fármacos que pueden proteger la mucosa reducen el número de tales eventos.
En las primeras 2 semanas, la trombosis venosa profunda puede detectarse mediante ecografía en el 40% de los pacientes. Los pacientes con déficits neurológicos graves y concentraciones elevadas de dímero D tienen el mayor riesgo. La tasa de trombosis venosa profunda clínica fue del 4%. y embolia pulmonar al 1% en 3 meses, en un análisis combinado de pacientes tratados con placebo en ensayos fVIIa Christensen, Dawson, & Vincent, (2008). El séptimo pa- nel del American College of Chest Physi- cians recomienda que se pueda iniciar un régimen de dosis baja de heparina subcu- tánea o heparina de bajo peso molecular el segundo día después del inicio de la hemo- rragia intracerebral en pacientes neurológicamente estables.
Un pequeño estudio realizado por Boeer, Voth, & Henze, (2001) mostró una baja in- cidencia de embolia pulmonar sin una tasa incremental de nueva hemorragia intrace- rebral si se inició heparina en dosis bajas el segundo día después del inicio (en com- paración con intervalos posteriores) Una vez que se desarrolla una tromboembolia venosa profunda, el tratamiento debe ad- ministrarse a pacientes con alto riesgo de embolia pulmonar. Los filtros inferiores en la vena cava o un ciclo de 5 a 10 días de dosis completa de heparina de bajo peso molecular seguido de 3 meses de heparina de bajo peso molecular en dosis más bajas son posibles alternativas a la warfarina.
El 10% de los pacientes tratados intensi- vamente con hemorragia intracerebral ne- cesitan traqueostomías, y el uso temprano podría reducir el riesgo de aspiración y ven- tilación mecánica a largo plazo. Las guías recientes han puesto énfasis en el control de la hipertermia y la hiperglucemia con medicación antipirética y posiblemente in- fusión de insulina en pacientes agudos. pe- ríodo de hemorragia intracerebral.
Hemorragia intracerebral relacionada con el uso de anticoagulantes orales
Aunque la mayoría de los casos asociados con el uso de anticoagulantes orales ocu- rren cuando las proporciones internacionales normalizadas están dentro del rango terapéutico, las proporciones más altas aumentan el riesgo. La edad avanzada y la angiopatía amiloide cerebral también son factores importantes que contribuyen a la hemorragia intracerebral asociada con el anticoagulante oral. En un estudio multicéntrico se observó, un deterioro neurológico progresivo durante las primeras 24-48 h en casi la mitad de los pacientes con hemo- rragia intracerebral asociada al uso de an- ticoagulantes orales y una alta mortalidad (64%) a los 6 meses Sjoblom, Hardemark, & Lindgren, (2011). La alta mortalidad en es- tos pacientes estuvo mediada por una alta tasa de agrandamiento temprano y tardío del hematoma, que comúnmente se aso- ció con un índice internacional normalizado persistentemente alto después del ingreso.
La cuestión clínica con respecto a la reposición de la anticoagulación es controvertida. Dos estudios concluyeron que los fármacos antitrombóticos deben evitarse siempre que sea posible en pacientes con hemorragia intracerebral aguda Keir, Wardlaw, Sandercock, & Chen, (2012). Un subgrupo con alto riesgo de accidente cerebrovascular tromboembólico y bajo riesgo de recurrencia podría beneficiarse de la anticoagulación a largo plazo o la aspirina. Tanto el ASA Stroke Council como las guías de EUSI recomiendan que se pueda comenzar de nuevo con warfarina en pacientes con un riesgo muy alto de tromboembolismo entre los 7 y 14 días posteriores al inicio de la hemorragia intracerebral original.
Conclusiones
La evidencia clínica sugiere la importancia de tres tareas de manejo en la hemorragia intracerebral: detener el sangrado, remover el coágulo, y controlar la presión de perfusión cerebral. La precisión necesaria para lograr estos objetivos y el grado de beneficio atribuible a cada objetivo clínico requiere aun de mas estudios como se menciona en la presente revisión.
El uso de resonancia magnética de campo alto en tiempo real con imágenes tridimen- sionales y sondas de tejido de alta resolución son una prioridad, así mismo, los en- sayos de tratamiento de la presión arterial aguda y la reversión de la coagulopatía, au- nado a ello, los ensayos de técnicas quirúrgicas mínimamente invasivas, incluidos los complementos mecánicos y farmacológicos, vienen siendo prioridades quirúrgicas.
Se necesita una mejor comprensión de los desafíos metodológicos, incluido el establecimiento de redes de investigación y enfoques de multidisciplinares para contri- buir sustancialmente al conocimiento sobre la eficacia del tratamiento para la hemorra- gia intracerebral y disminuir su morbimortalidad.
REFERENCIAS BIBLIOGRÁFICAS
Bailey, R., Hart, R., Benavente, O., & Pearce, L. (2011). Recurrent brain hemorrhage is more frequent than ischemic stroke after intracranial hemorrhage. Neurology, 773–77.
Bhattathiri, P., Gregson, B., & Prasad, K. (2016). Intraventricular hemorrhage and hydrocephalus after spontaneous intracerebral hemorrhage: results from the STICH trial. Acta Neurochir Suppl, 65–68.
Boeer, A., Voth, E., & Henze, T. (2001). Early heparin therapy in patients with spontaneous intracerebral haemorrhage. J Neurol Neurosurg Psychiatry, 466–67.
Bolívar, J. (2015). Investigación Documental. México. Pax.
Broderick, J., Connolly, S., & Feldmann, E. (2007). Directrices para el tratamiento de la hemorragia intracerebral espontánea en adultos: actualización de 2007: una directriz de la American Heart Association / American Stroke Association Stroke Council, High Blood Pressure Research Council y Quality of Car. PubMed: 17478736, 38: 2001–23.
Carhuapoma, J., Wang, P., & Beauchamp, N. (2010). Diffusion-weighted MRI and proton MR spectroscopic imaging in the study of secondary neuronal injury after intracerebral hemorrhage. Stroke, 726–32.
Castro, J. (2016). Técnicas Documentales. México. Limusa.
Christensen, M., Dawson, J., & Vincent, C. (2008). Risk of thromboembolic complications after intracerebral hemorrhage according to ethnicity. Adv Ther, 831–41.
Davila, A. (2015). Diccionario de Términos Científicos. . Caracas: Editorial Oasis.
Davis, S., Broderick, J., & Hennerici, M. (2006). Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage. Neurology, 1175–81.
Dziedzic, T., Szczudlik, A., & Klimkowicz, A. (2013). Is mannitol safe for patients with intracerebral hemorrhages? Renal considerations. Clin Neurol Neurosurg, 87–89.
Graham, D., McIntosh, T., & Maxwell, W. (2010). Recent advances in neurotrauma. J Neuropathol Exp Neurol, 641–51.
Gujjar, A., Deibert, E., & Manno, E. (2008). Mechanical ventilation for ischemic stroke and intracerebral hemorrhage: indications, timing, and outcome. Neurology, 447–55.
Hemphill, J. 3., Newman, J., Zhao, S., & Johnston, S. (2014). Hospital usage of early do-not-resuscitate orders and outcome after intracerebral hemorrhage. Stroke, 1130–34.
Keir, S., Wardlaw, J., Sandercock, P., & Chen, Z. (2012). Antithrombotic therapy in patients with any form of intracranial haemorrhage: a systematic review of the available controlled studies. Cerebrovasc Dis, 197–206.
Kidwell, C., Chalela, J., & Saver, J. (2014). Comparison of MRI and CT for detection of acute intracerebral hemorrhage. JAMA, 1823–30.
Labovitz, D., Halim, A., & Boden-Albala, B. (2015). The incidence of deep and lobar intracerebral hemorrhage in whites, blacks, and hispanics. Neurology, 518–22.
Mayer, S., Davis, S., & Begtrup, K. (2008). Subgroup analysis in the FAST trial: a subset of intracerebral hemorrhage patients that benefit from recombinant activated factor VII. Stroke, 528.
Mendelow, A., & Unterberg, A. (2007). Surgical treatment of intracerebral haemorrhage. Curr Opin Crit Care. 13:169–74.
Ohwaki, K., & Yano, E. (2004). Blood pressure management in acute intracerebral hemorrhage: relationship between elevated blood pressure and hematoma enlargement. Stroke. 2004. [PubMed: 15118169], 35:1364–67.
Organization, A. H. (2017, Nov 21). International cardiovascular disease statistics: cardiovascular disease (CVD). Retrieved from http://www.americanheart.org/downloadable/heart/1140811583642InternationalCVD.pdf
Qureshi, A., Geocadin, R., & Suarez, J. (2000). Long-term outcome after medical reversal of transtentorial herniation in patients with supratentorial mass lesions. Crit Care Med, 1556–64.
Qureshi, A., Tuhrim, S., Broderick, J., & Batjer, H. (2011). Spontaneous intracerebral hemorrhage. N Engl J Med., 1450–60.
Sjoblom, L., Hardemark, H., & Lindgren, A. (2011). Management and prognostic features of intracerebral hemorrhage during anticoagulant therapy: a Swedish multicenter study. Stroke, 2567–74.
Smith, E., & Gurol, M. (2014). White matter lesions, cognition, and recurrent hemorrhage in lobar intracerebral hemorrhage. Neurology, 1606–12.
Steiner, T., & Diringer, M. (2013). Dynamics of intraventricular hemorrhage in patients with spontaneous intracerebral hemorrhage: risk factors, clinical impact, and effect of hemostatic therapy with recombinant activated factor VII. Neurosur, 34-42.
Sumer, M., Acikgoz, B., & Akpinar, G. (2012). External ventricular drainage for acute obstructive hydrocephalus developing following spontaneous intracerebral haemorrhages. Neurol Sci, 29–33.
Tuhrim, S. (2008). Intracerebral hemorrhage—improving outcome by reducing volume? N Engl J Med, 2174–76.
Wang, C., & Shuaib, A. (2007). Neuroprotective effects of free radical scavengers in stroke. Drugs Aging, 537–46.
Weimar, C., Weber, C., & Wagner, M. (2013). Management patterns and health care use after intracerebral hemorrhage. a cost-of-illness study from a societal perspective in Germany. Cerebrovasc Dis, 29–36.
Yang, S., Nakamura, T., & Hua, Y. (2016). The role of complement C3 in intracerebral hemorrhage-induced brain injury. J Cereb Blood Flow Metab, 1490–95.
Zurasky, J., Aiyagari, V., & Zazulia, A. (2015). Early mortality following spontaneous intracerebral hemorrhage. Neurology, 725–27.